Reaktionen av interaktionen mellan CaCl2, H2SO4
Ett av stubbarna i de första stegenStudien av kemiska regelbundenhet och grundläggande är skrivandet av kemiska reaktioner. Därför är frågor om interaktionen av CaCl2, H2SO4 inte ens periodiskt men systematiskt. Låt oss analysera de viktigaste problemen med "problem".
Anteckningen över molekylekvationen
Samspelet mellan kalciumklorid (salt) och svavelsyra fortsätter enligt växelmekanismen.
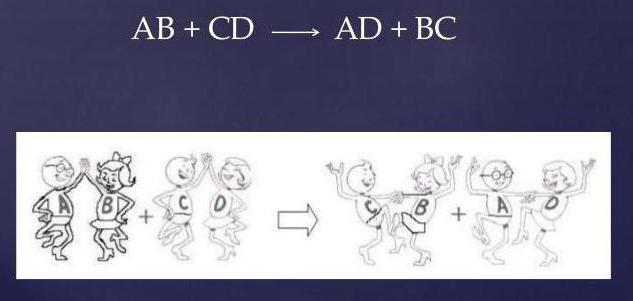
- två föreningar vid inloppet (utgångsmaterial);
- två anslutningar vid uttaget (produkter);
- fullständig frånvaro av enkla ämnen.
Genom att utbyta reaktionsgrupper med varandra modifieras reagensen, och ekvationen har formen:
CaCl2 + H2S04 = CaS04 + 2HCl.
Såsom kan ses, bildar två komplexa ämnen, skiftande joner, helt olika föreningar: ett nytt salt (CaSO4) och saltsyra (HCl).
Möjlighet att flyta till slutet
Du kan enkelt svara på denna fråga genom att skriva reaktionsekvationen i molekylär form för CaCl2, H2SO4. Från den sortens produkter och allt kommer att bero på. Fram till slutet av processen är det i fråga om utbildning:
- en lättlöslig substans (fällning);
- en flyktig förening (gas);
- lågupplösande reagens (vatten, svag elektrolyt).
Som ersättning för CaCl2, H2SO4 fall finns bland kalciumsulfat reaktionsprodukter - svårlöslig förening faller ut enligt tabellen.
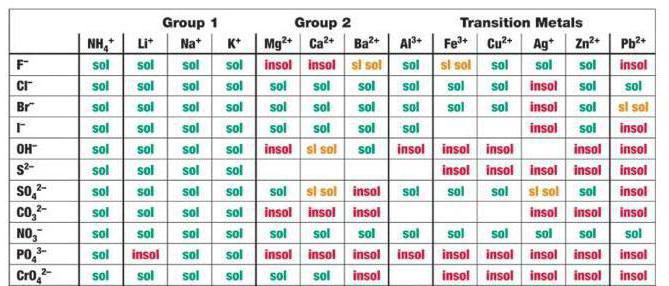
Följaktligen kommer utbytesprocessen att gå till slutet.
Den reducerade jonformen av inspelningen mellan CaCl2, H2SO4
Efter att ha målat alla lösliga föreningar på joner och reducerar de repetitiva reaktionsgrupperna erhåller vi de två erforderliga ekvationerna:
- Den totala jonformen för inspelningen mellan CaCl2, H2SO4
ca2+ + 2cl- + 2h+ + så42- = caso4 + 2h+ + 2cl-
- den reducerade formen av ekvation
ca2+ + så42- = caso4.
Det bör komma ihåg att joner endast är måladelösliga salter, syror, baser (detta bestäms enkelt av särskilda tabeller). Svaga elektrolyter, såsom kol eller ättiksyra, skrivs alltid i molekylär form.
Nu vet du hur interaktionen mellan kalciumklorid (salt) och svavelsyra sker.

