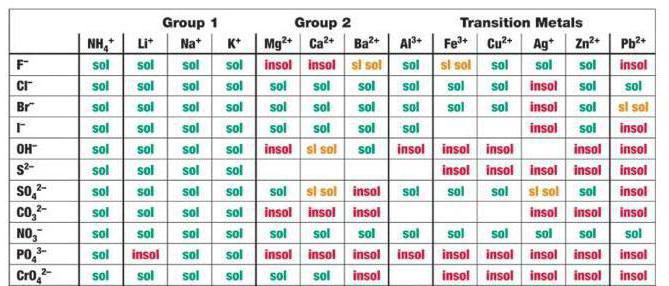
Halogener är ... Halogenföreningar
Här kommer läsaren att hitta information om halogener,kemiska element i det periodiska systemet för DI Mendeleyev. Innehållet i artikeln kommer att göra det möjligt för dig att bekanta dig med deras kemiska och fysiska egenskaper, hitta i naturen, användningsmetoder etc.
Allmän information
Halogener är alla delar av det kemiska bordet DI Mendeleyev, som ligger i den sjuttonde gruppen. Med en mer noggrann klassificeringsmetod är dessa alla delar i den sjunde gruppen, den huvudsakliga undergruppen.

Halogener är element som kan gå medreaktioner med praktiskt taget alla ämnen av en enkel typ, med undantag för ett visst antal icke-metaller. Alla dessa är energi oxidationsmedel, eftersom under förhållandena för natur, tenderar att vara i en blandad form med andra substanser. Indexet för kemisk aktivitet hos halogener minskar med ökad nummerering.
Halogener är följande element: fluor, klor, brom, jod, astat och artificiellt skapade tennesses.
Som tidigare nämnts är alla halogeneroxidanter med uttalade egenskaper, förutom alla är nonmetals. Den externa energinivån har sju elektroner. Samverkan med metaller leder till bildandet av jonbindningar och salter. Nästan alla halider förutom fluorid, kan visa sig som ett reduktionsmedel, oxidationsgraden kulminerar 7, men detta kräver att de interagerar med element som har en större grad av elektronegativitet.
Funktioner av etymologi

År 1841 den svenska kemisten J. Berzelius föreslagit införandet av uttrycket halogen, med hänvisning till dem kända vid tidpunkten F, Br, I. Emellertid, fram till införandet av begreppet i förhållande till hela gruppen av element, i 1811, tysk vetenskapsman I. Shveygger samma ord kallas klor, termen översattes från grekiska som ett "salt".
Atomstruktur och oxidationsförmåga
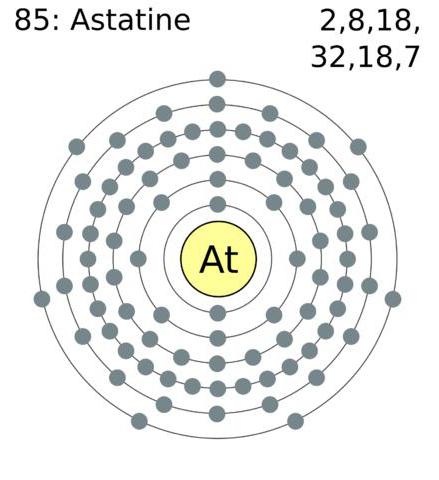
Konfigurationen av elektronerna hos det yttre atomskalet av halogener är som följer: astat-6s26p5, jod - 5s25p5, brom 4s24p5, klor - 3s23p5, fluor 2s22p5.
Halogener är element som har på elektronikenskal av extern typ av sju elektroner, vilket gör det möjligt för dem "utan mycket ansträngning" att fästa en elektron, vilket inte räcker för att slutföra skalet. Typiskt uttrycks oxidationstillståndet som -1. Cl, Br, I och At reagera med element med högre grad, börjar visa en positiv oxidativ grad: +1, +3, +5, +7. Fluorid har en konstant oxidationsgrad -1.
spridning
Med tanke på dess höga grad av reaktionHalogenernas förmåga är vanligen i form av föreningar. Utbredningsnivån i jordskorpan minskar i takt med ökningen av atomraden från F till I. Astat i jordskorpan mäts i gram totalt och tennessina skapas konstgjort.
Halogener finns oftast i naturenföreningar av halogenider och jod kan också ha formen av kaliumjodat eller natrium. På grund av deras löslighet i vatten är de närvarande i havsvatten och saltlösningar av naturligt ursprung. F är en olöslig representant för halogener och finns oftast i sedimentära bergarter och dess huvudkälla är kalciumfluorid.
Fysikaliska kvalitativa egenskaper
Halogener i sig kan vara mycket olika, och de har följande fysikaliska egenskaper:
- Fluor (F2) - en gas av ljusgul färg, har en skarp och irriterande lukt, och är inte utsatta för kompression i normala temperaturer. Smältpunkten är -220 ° C och kokpunkten -188 ° C.
- Klor (Cl2) är en gas som inte avtalar medDen vanliga temperaturen, även när den utsätts för tryck, har en kvävande, skarp lukt och en gröngul färg. Smältningen börjar vid -101 ° C och kokar vid -34 ° C.
- Brom (Br2) Är en flyktig och tung vätska med en brunbrun färg och en skarp fetid lukt. Den smälter vid -7 ° C och kokar vid 58 ° C.
- Jod (I2) - Denna fasta substans har en mörkgrå färg och den har en metallisk glans, lukten är ganska skarp. Smältningsprocessen börjar vid 113,5 ° C och kokar vid 184,885 ° C.
- En sällsynt halogen är en astatin (At2), som är en fast och har en svart och blå färg med metallisk glans. Smältpunkten motsvarar ett märke av 244 ° C, och kokningen börjar efter att ha nått 309 ° C.

Halogenens kemiska natur
Halogener är väldigt högaoxidativ aktivitet, som försvagas i riktning från F till At. Fluor, som är den mest aktiva representanten för halogener, kan reagera med alla typer av metaller, inte uteslutande kända. De flesta företrädare för metaller, kommer in i atmosfären av fluor, genomgår självantändning, samtidigt som de släpper ut värme i stora mängder.
Utan exponering för fluor för värme kan detreagera med ett stort antal icke-metaller, exempelvis H2, C, P, S, Si. Typen av reaktioner i detta fall är exoterm och kan åtföljas av en explosion. Vid uppvärmning tvingar F de resterande halogenerna att oxidera, och när de utsätts för bestrålning, kan detta element reagera med tunga gaser av inert natur.
Genom att interagera med ämnen av komplex typ orsakar fluor höga energiska reaktioner, exempelvis genom att oxidera vatten, det kan orsaka en explosion.

Klor kan också vara reaktivt, särskilt ifri stat. Nivån av dess aktivitet är mindre än den för fluor, men den kan reagera med nästan alla enkla ämnen, men kväve, syre och ädelgaser reagerar inte med det. Samverkan med väte, med uppvärmning eller bra belysning skapar klor en våldsam reaktion åtföljd av en explosion.
I additions- och substitutionsreaktionerna kan Clreagera med ett stort antal ämnen av komplex typ. Kan förskjuta Br och I genom upphettning av en förening som skapas av dem med en metall eller väte, och kan också reagera med alkaliska ämnen.
Brom är kemiskt mindre aktiv än klor eller fluor,men visar sig fortfarande mycket starkt. Detta beror på det faktum att brom Br ofta används som en vätska, eftersom i detta tillstånd den initiala graden av koncentration under andra identiska förhållanden är högre än den hos Cl. Till stor del används i kemi, särskilt organisk. Kan lösas i H2O och reagera med det delvis.
Halogenelementet jod bildar en enkel substans I2 och kan reagera med H2O, löses i jodidlösningar, bildandeDet här är de komplexa anjonerna. Från de flesta halogener skiljer jag mig från att det inte reagerar med de flesta icke-metalliska ämnen och reagerar långsamt med metaller, medan det behöver värmas upp. Med väte reagerar, genomgår endast stark uppvärmning, och reaktionen är endoterm.
En sällsynt halogenatat (At) visar mindre reaktivitet än jod, men kan reagera med metaller. Som ett resultat av dissociation uppstår både anjoner och katjoner.
tillämpningar
Föreningar av halogener används i stor utsträckning av människor i en mängd olika verksamhetsområden. Naturkryolit (Na3AlF6) används för att förbereda Al. Brom och jod används ofta som enkla ämnen av farmaceutiska och kemiska företag. Vid produktion av reservdelar till bilar används ofta halogener. Strålkastare är en av dessa detaljer. Kvalitativt välja materialet för denna komponent i maskinen är mycket viktigt, eftersom lamporna tänder vägen på natten och är ett sätt att upptäcka både dig och andra bilister. Ett av de bästa kompositmaterialen för framställning av strålkastare är xenon. Halogen är emellertid underlägsen kvalitet i denna inerta gas.

En bra halogen är fluor, en tillsats som används i stor utsträckning vid tillverkningen av tandkräm. Det hjälper till att förebygga förekomsten av tandvårdssjukdomar - karies.
Ett sådant element-halogen, som klor (Cl), finnerdess användning i HCl beredning, användes ofta vid syntes av organiska ämnen såsom plast, gummi, syntetfibrer, färgämnen och lösningsmedel och liknande. d. Och även klorföreningar används som bleknings linne och bomullsmaterial, papper, och som ett medel för att styra bakterier i dricksvatten.

OBS! Toxic!
Med tanke på den mycket höga reaktivitetenHalogens förmåga är med rätta kallad giftig. Tydligast är förmågan att ansluta sig till reaktionen uttryckt i fluor. Halogener har uttalat kväveegenskaper och kan påverka vävnader under interaktion.
Fluor i ånga och aerosoler anses vara en av de mestpotentiellt farliga former av halogener, skadliga för omgivande levande saker. Detta beror på att det är dåligt uppfattat av luktsinne och känns först efter att ha nått en hög koncentration.
Sammanfattning
Som vi ser är halogener väldigt viktigadel av det periodiska systemet, de har många egenskaper som skiljer sig i den fysikaliska och kemiska kvalitet, atomstruktur, oxidationsgrad och förmåga att reagera med metaller och icke-metaller. Industrin använder ett antal olika sätt, allt från tillsatser i produkter för personlig hygien och efterbehandling ämnen syntes av organisk kemi eller blekmedel. Trots att en av de bästa sätten att upprätthålla och skapa ljus i bilen strålkastare är xenon, halogen, är det ändå inte sämre och är också i stor utsträckning och har sina egna fördelar.
Nu vet du vilken halogen är. Skanvord med några frågor om dessa ämnen för dig är inte längre ett hinder.